リード文の分析【4年生以上対象】 2010-08-03
リード文の分析【対象学年:4年生以上】

水素を燃やすと水が、炭素を燃やすと二酸化炭素が、メタンガスを燃やすと水と二酸化炭素ができます。
このような物質の変化を化学変化といいますが、どうしてこのようなことが起こるのか、昔から多数の科学者によって研究されてきました。
そして現在では、物質は原子と呼ばれる小さな粒からできていて、すべての物質は原子がいくつか集まってできているということと、化学変化はその組み合わせが変わることだとわかっています。
そしてそのときは、組み合わせのみが変わるだけなので、化学変化の前後での原子の総数は変わりませんし、それぞれの原子の重さが化学変化によって変わることもありません。
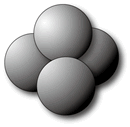
たとえば水素の粒(水素分子という)は水素の原子2個から、酸素の粒(酸素分子)は酸素原子2個から、水の粒(水分子)は水素原子2個と酸素原子1個からできているので,水素を燃やして水ができる化学変化を図1で説明すると次のようになり,水素分子2個と酸素分子1個とから水分子が2個できることがわかります。
また、炭素の粒1個と反応する酸素ガスの粒は1個で,反応のようすは図2のようになります。
ただし,以下の図では次のような記号を使います。また原子1個は本来とても小さくて軽いものですが、扱いやすいように、水素原子1個の重さを1g、酸素原子1個の重さを16g、炭素原子1個の重さを12gとします。 (頌栄女子学院・改題)
問 メタンガスが燃えるときのようすについて答えなさい。
(1) メタンガスの粒1個が燃えるときの反応のようすを図1,図2にならって書きなさい。
ただし,メタンガスの粒1個は炭素原子1個と水素原子4個とからできていて,図3のように表すものとします。
(2) 64gのメタンガスを燃やすために必要な空気は何gですか。
ただし,空気の重さのうち20%が酸素であるとして考えなさい。
リード文と与えられた図から、物が燃えるときのルールを考えましょう。

(1) 
(2) 1280g

(1)まず、リード文と図をよく読みながら、ものが燃えるときの法則を考えます。
すると、ものが燃えるときには
「2個の原子からなる酸素の粒が、ある物質と組み合わさって、水や二酸化炭素となる・・・(ア)」
そのとき
「反応の前後でそれぞれの原子の粒の数は変わらない・・・(イ)」
ことがわかります。
よって(1)の問題については
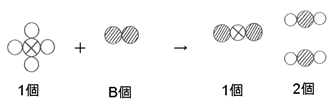
という式のA~Dの部分の数を調整すればいいことが分かります。
ここで、→の左側には炭素原子が1つ、右側にも炭素原子が1つですから、AとCが1であるとしましょう。
Aが1だとすると→の左側には水素原子が4個あるので、右側にも水素原子が4個必要です。
よって水の部分のDは2となりそうです。
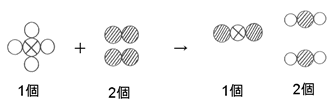
ここまでを整理すると
となります。
→の右側には、酸素原子の粒が4個なので、Bを2とすれば、→左側の酸素原子も4個となり、→の前後で原子の数が
そろうので、これが解答となります。
(2)(1)で作った図式に実際の数字を当てはめてみると。
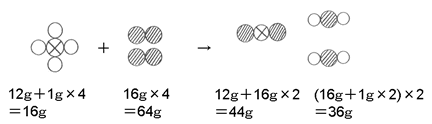
となります。→の前後で重さが変わっていないことが確かめられました。
さて、メタンガスは64gですから、上の図式が4つ分あることがわかります。
よって必要な酸素の重さは
64×4=256g
ですね。酸素の重さは空気の20%ですから、求める空気の重さは
256g÷0.2=1280g となります。
知っている大人にとっては何の変哲もない化学式の問題ですが、それを知らないお子様にとって、入試でこの問題をみたら面食らうかもしれません。そういうときこそ慌てずにリード文や図をしっかり読み、情報を整理していくことが必要です。読解力と現場での思考力・作業する力が要求されますが、しっかりそれができれば、4年生でも(%の概念を知っていれば)きちんと正解にたどりつける良問です。
-------------------------------------------------------------------------------------------------------
~2箇所でブログランキングに参加しています~
1.
2.![]()
-------------------------------------------------------------------------------------------------------
ところで、こんなのはじめました。
参考書選びの参考にご利用ください。
ロジム2階参考書コーナー